Immunohistochimie en Multiplex
Principe
L’immunohistochimie en multiplex est une technique plus récente qui permet de réaliser de multiples immunomarquages séquentiellement et donc d’étudier de nombreux co-marquages. Elle est basée sur le système d’amplification de signal par la Tyramide.
Méthode de l’immunohistochimie en multiplex
- Le premier immunomarquage est réalisé sur la coupe
- La peroxydase conjuguée à l’anticorps secondaire catalyse la conversion des molécules de tyramide en radicaux libres hautement réactifs qui vont former des liaisons covalentes à proximité de l’épitope
- L’élimination du couple anticorps primaires/anticorps secondaires par chauffage (« stripping ») préserve la TSA liée et le fluorochrome rapporteur
- Le processus peut être répété avec un nouvel anticorps primaire, jusqu’à ce que toutes les cibles d’intérêt soient détectées, en utilisant un fluorochrome de longueur d’onde différente pour chaque marquage.
La technologie repose sur la capacité :
- De la TSA couplée au fluorochrome à être liée de manière covalente aux tissus
- À éliminer efficacement les anticorps entre les cycles de coloration
- Des antigènes à résister à la chaleur
Avantages de la technologie de l’immunohistochimie en multiplex
- Signal augmenté (x10 à x100)
- Résolution exceptionnelle
- Volume d’anticorps primaires utilisé réduit
- Diminution du temps d’incubation (min 1h)
- La liaison covalente établit par la technique est idéal pour le multiplexage
A disposition sur la plateforme Histomics de l’Institut du Cerveau (Paris)
La plateforme met à disposition un ensemble de réactifs pour la réalisation de vos immunohistochimies (ex : sérum, BSA, anticorps secondaires fluorescents, système de révélation, DAB, Dapi, milieu de montage, …etc).
Kit Akoya :8 fluorophores : Opal480, Opal520, Opal 540, Opal 570, Opal 620, Opal 650, Opal 690 et Opal 780
Les anticorps primaires restent à la charge des utilisateurs.
|
|
Hybridation in situ (RNASCOPE)
Principe
RNAscope est une méthode d’hybridation in situ utilisant des paires de sondes en Z contenant une séquence complémentaire de 18 à 25 nucléotides à l’ARN cible et une séquence complémentaire à l’amplificateur. Les deux sondes de chaque paire doivent s’hybrider indépendamment à leurs séquences cibles respectives. Les amplificateurs se lient ensuite sur la paire de sondes. Le signal de détection est obtenu par un système d’amplification par la tyramide-Fluorophore.
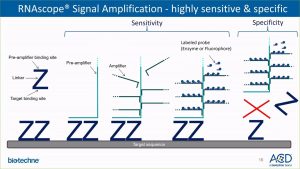
Avantages :
- Spécificité élevée
- Sensibilité élevée : possibilité de détecter des ARNs partiellement dégradés
- Rapport signal/bruit élevé
- Multiplexage : possibilité de détecter jusqu’à 6 ARNs différents
- Compatible avec divers types de tissu : coupes tissulaires ou échantillon entier (organoïde, DRG…)
- Combinaison avec immunofluorescence possible
- Automatisation possible : automate Bond RX
|
|
Transcriptomique spatiale
GeoMx Digital Spatial Profiler
La technologie GeoMx DSP est une technologie de transcriptomique et protéomique spatiale basée sur le séquençage nouvelle génération. Elle permet d’étudier plus de 20 000 ARN et 150 protéines. Elle est adaptée aux divers tissus (congelé ou paraffine). Les ARN ou protéines d ’intérêts sont détectés par des sondes ou des anticorps couplés à une molécule photoclivable avec un code-barre spatial permettant ainsi de les localiser dans le tissu. Nous fournissons un panel de marqueurs morphologiques (IBA-1, GFAP, Olig2, CD3, PanCK…) permettant de sélectionner des populations cellulaires ou des régions d’interet dans le tissu. La lame histologique est imagée sur la plateforme GeoMx DSP. A l’aide de marqueurs morphologiques, les régions d’intérêt sur la coupe de tissu sont sélectionnés puis illuminées par la lumière UV afin de cliver les oligonucléotides contenant les code-barres spatiaux. Ces oligonuclétides sont aspirés et collectés dans une plaque à 96 puits. Ils sont ensuite amplifiés et séquencés sur une plateforme illumina. GeoMx DSP intègre ensuite les données de séquençage aux données histologiques pour une analyse de transcriptomes ou protéomes.
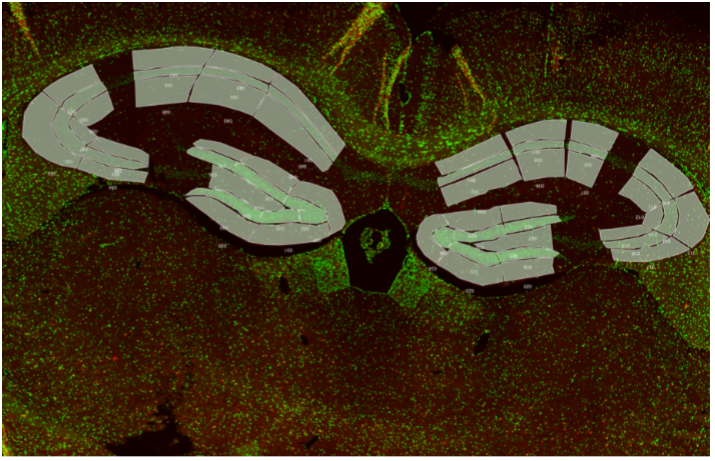 Cerveau de souris. IBA-1 (rouge) et noyau (vert). Profilage de régions anatomiques de l’hippocampe (zones blanches).
Cerveau de souris. IBA-1 (rouge) et noyau (vert). Profilage de régions anatomiques de l’hippocampe (zones blanches).
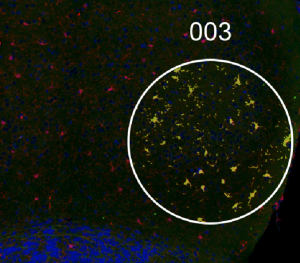 Transcriptomique spatiale par GeoMx DSP_ Cerveau de souris. IBA-1 (rouge) et noyau (bleu).Profilage de populaire de microglies (zones jaune).
Transcriptomique spatiale par GeoMx DSP_ Cerveau de souris. IBA-1 (rouge) et noyau (bleu).Profilage de populaire de microglies (zones jaune).
Visium
a) Visium V1
La technologie Visium est une technologie de transcriptomique spatiale basée sur le séquençage nouvelle génération qui permet une analyse de l’intégralité de transcriptomes sur une coupe de tissu.
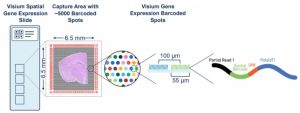
Visium V1 utilise une lame contenant des spots recouverts de poly(dT), permettant ainsi de capturer l’ensemble des ARNm du tissu. Une coloration HE ou une immunofluorescence est réalisée au préalable afin d’obtenir des informations morphologiques du tissu. Le tissu est ensuite perméabilisé pour libérer les ARNm qui seront capturés par des poly(dT). Les ARNm capturés sont rétro-transcrits en ADNc, puis amplifiés et séquencés sur une plateforme Illumina. Les données de séquençage et l’image histologique sont alignées dans le logiciel SpaceRanger de 10X Genomics permettant ainsi de cartographier les profils d’expression génique sur la coupe de tissu. Les données obtenues permettent d’associer l’expression des gènes à des régions tissulaires précises, avec une résolution limitée à la taille des spots (55 µm).
Cartographie de clusters cellulaires sur une coupe de cerveau de souris greffé de cellules de glioblastome humain.
b) Visium V2
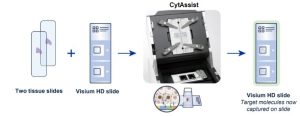
La version V2 de Visium améliore la sensibilité et la qualité des données transcriptomiques par rapport à la version V1. La technologie utilise une lame de 2 zones de capture de 6,5 x 6,5 mm ou 11 x 11 mm, optimisés pour capturer davantage d’ARNm et augmenter le nombre de gènes détectés par spot. La zone de capture présente respectivement environ 5000 ou 14000 spots barcodés de 55 µm chacun. Les informations morphologiques du tissu (coloration HE ou immunofluorescence) sont obtenues sur une lame histologique standard. L’hybridation est ensuite réalisée à l’aide d’un panel de sondes (humaines ou murines) Une ligase est ajoutée après l’hybridation afin de créer une jonction entre les sondes hybridées à l’ARN. Les produits de ligation sont relâchés et capturés sur la lame Visium V2 à l’aide d’un CytAssist (10X Genomics), pour être enfin élués et amplifiés en vue de la construction des librairies.

c) Visium HD
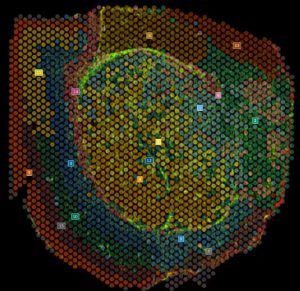
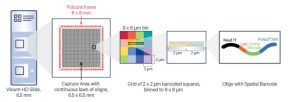
La technologie Visium HD propose une résolution spatiale améliorée par rapport à la V2, avec des spots plus petits, plus nombreux ainsi qu’ une résolution proche de l’échelle cellulaire.
La lame Visium HD présente 2 zones de capture de 6,5 x 6,5 mm avec des spots de 2µm . Cela permet de cartographier l’expression génique avec une finesse accrue et de mieux distinguer les cellules voisines. Le protocole Visium HD suit des étapes similaires à la version V2, avec une étape impliquant l’utilisation du CytAssist pour le relâche et la capture des produits de ligation. Comme pour Visium V1 et V2, une cartographie des profils d’expression génique est réalisée via SpaceRanger, en super posant les données de séquençage et l’image histologique.
Xenium
Xenium de 10x Genomics est une technologie avancée de transcriptomique spatiale basée sur l’imagerie et l’hybridation in situ séquentielle. Xenium permet l’analyse simultanée de l’expression de centaines d’ARNs sur des sections tissulaires. Cette technologie permet d’étudier et localiser des ARNs d’intérêt avec précision grâce à sa résolution spatiale subcellulaire. Xenium est adapté aux divers types de tissu tel que des tissus paraffine, tissus congelés fixés ou non fixé, et permet d’étudier plusieurs coupes tissulaires simultanément sur la même lame.
Le tissu est d’abord perméabilisé afin de libérer des ARNs d’intérêt. Ces derniers sont ensuite détectés par hybridation in situ avec des sondes complémentaires. Des étapes de ligation et d’amplification des sondes hybridés sont ensuite réalisées pour augmenter le signal fluorescent, facilitant ainsi la détection précise des transcrits. Ces sondes amplifiées sont ensuite détectées par des sondes de lectures fluorescentes permettant ainsi de visualiser et localiser des ARN d’intérêt.
Afin de faciliter l’analyse de données, un protocole de segmentation cellulaire basé sur une approche multimodale est également disponible.
Les noyaux sont colorés au DAPI, le cytoplasme est marqué par l’ARN ribosomique 18S et les membranes cellulaires peuvent être détectés par des anticorps spécifiques.
Les données de l’expérience sont ensuite analysées à l’aide du Xenium Analyzer, un automate qui capture des images à haute résolution et effectue une analyse spatiale des données d’expression génique, intégrant les informations de segmentation cellulaire.
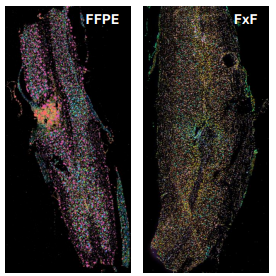 Comparaison d’un profil d’expression entre des deux coupes (FFPE et congelé) de moelle épinière de souris induite par la LPC (lysolecithine)
Comparaison d’un profil d’expression entre des deux coupes (FFPE et congelé) de moelle épinière de souris induite par la LPC (lysolecithine)
Transparisation des tissus
La transparisation des tissus est une technique récente qui permet de rendre les organes optiquement transparents afin de faciliter leur observation au microscope. Elle permet de visualiser un environnement complexe (eg cerveau) dans son intégralité sans recourir à des coupes sériées.
Méthode Disco
Principe
Etape 1 : Blanchiement et perméabilisation des échantillons
Etape 2 : Immunomarquage
Etape 3 : Transparisation chimique permettant l’élimination des lipides
Etape 4 : Imprégnation dans le milieu de montage
Avantages de la méthode :
Préservation de la morphologie et de la taille des échantillons
Meilleure résolution à l’acquisition des images
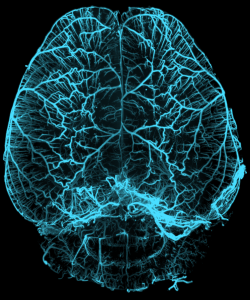 Image 3D est reconstruite sur Imaris d’un cerveau adulte de souris C57Bl6 avec marquage smooth muscle actin (alphaSMA) en vue dorsale (Myriam Spajer)
Image 3D est reconstruite sur Imaris d’un cerveau adulte de souris C57Bl6 avec marquage smooth muscle actin (alphaSMA) en vue dorsale (Myriam Spajer)
Microdissection Laser
Préparation des échantillons
La préparation des échantillons est une étape fondamentale avant la microdissection. Il faut prendre en compte les contraintes liées à l’analyse en aval (ex. quantification d’ARNm, dosage de protéine etc.).
En général, les tissus frais et congelés sont préférés pour isoler l’ARN et les protéines. Les coupes congelées peuvent être obtenues rapidement sur un cryostat. Un ARN de haute qualité est obtenu à partir de tissus congelés immédiatement après la chirurgie, ce qui minimise sa dégradation au fil du temps par les RNases (activité tissu dépendant).
L’ADN, L’ARN peuvent aussi être préparés à partir de matériel congelé ou fixé au formol, même après enrobage paraffine. L’avantage de travailler avec des coupes enrobées de paraffine est une qualité morphologique supérieure par rapport aux coupes congelées. La préservation de la morphologie peut être critique pour le diagnostic et pour la sélection finale de cellules spécifiques à microdisséquer. Cependant, la préparation d’ARN à partir de coupes de paraffine fixées peut être difficile en raison de la dégradation de l’ARN par le formol (fixateur généralement utilisé pour les inclusions en paraffine).
Apres microdissection, les échantillons sont récupérés dans des tubes et l’extraction (ARN, ADN, Protéine) réalisée rapidement.
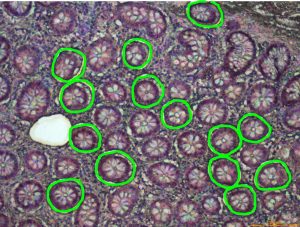 |
 |
Equipements disponibles sur la plateforme : 1 LMD7000 (Leica) lien vers page équipement


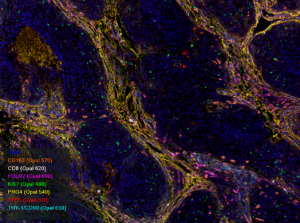 Human meningioma paraffin_ 8 plex_ Yu TERANISHI and Antoine BLOUIN_Team Huillard-Sanson
Human meningioma paraffin_ 8 plex_ Yu TERANISHI and Antoine BLOUIN_Team Huillard-Sanson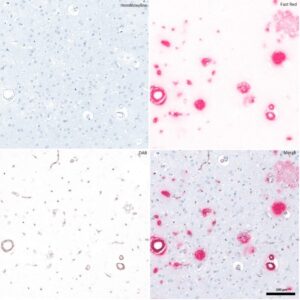 Marquage chromogène en paraffine ;Cerveau humain ; Kasri A. Eq. Potier-Haïk
Marquage chromogène en paraffine ;Cerveau humain ; Kasri A. Eq. Potier-Haïk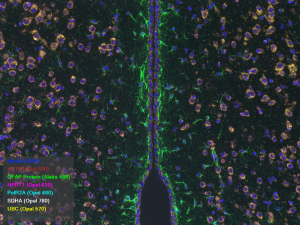 RNAscope automatisé : Coupe de cerveau murin_RNAscope 5-plex combiné à l’immunofluorescence de GFAP réalisé sur l’automate Bond RX
RNAscope automatisé : Coupe de cerveau murin_RNAscope 5-plex combiné à l’immunofluorescence de GFAP réalisé sur l’automate Bond RX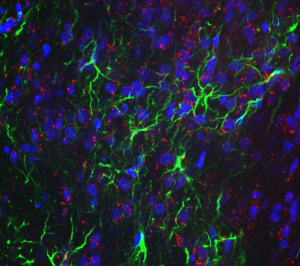 RNAscope 3D : Organoïde du mésencéphale humain_RNAscope PPIB combiné à l’immunofluorescence de GFAP
RNAscope 3D : Organoïde du mésencéphale humain_RNAscope PPIB combiné à l’immunofluorescence de GFAP